设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是
| A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果 |
| B.装置中Pt电极附近的pH增大 |
| C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 |
| D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 |
下列实验方案设计合理的是
| A.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液 |
| B.除去氯化铵溶液中的氯化铁:向溶液中滴加适量氢氧化钠溶液,过滤 |
| C.除去苯中的苯酚:向溶液中加入浓溴水,过滤 |
| D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,再滴加硝酸银溶液 |
.下列实验操作完全正确的是
| 编号 |
实验 |
操作 |
| A |
容量瓶查漏 |
加水、倒立、观察、正立 |
| B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C |
为确证NaHCO3固体中是否含Na2CO3 |
取少量待检固体溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成 |
| D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
常温下,下列各组离子,在所给条件下能够大量共存的是
A.pH=0的溶液中,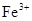 、 、 、 、 、 、 |
B.水电离出的c(H+)=1×1010的溶液中,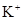 、 、 、Na+、 、Na+、 |
C.使pH试纸显深蓝色的溶液中,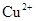 、 、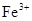 、 、 、 、 |
D.在 溶液中 溶液中 、SiO32-、NH4+、 、SiO32-、NH4+、 . . |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强
均相同,且甲的密度大于乙的密度,则下列说法正确的是:
| A.甲的分子数比乙的分子数多 | B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 | D.甲的相对分子质量比乙的相对分子质量小 |
.将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是