先在表中空白处填写相关的内容,再根据表中提供的信息回答下面的问题。
| 反应物Ⅰ |
反应物Ⅱ |
反应现象 |
说 明 |
| AgNO3溶液 |
NaCl溶液 |
生成白色沉淀 |
该沉淀为AgCl,不溶于稀硝酸 |
| BaCl2溶液 |
Na2SO4溶液 |
生成白色沉淀 |
该沉淀为BaSO4,不溶于稀硝酸 |
| Na2CO3溶液 |
|
生成白色沉淀 |
该沉淀为 ,溶于稀盐酸 |
由蒸发海水制得的粗盐中常含有Na2SO4、CaCl2、MgCl2等杂质,在食盐生产过程中需要将这些杂质除去。请回答下列问题。
(1)Na2SO4、CaCl2和MgCl2在溶液里能形成Na+、Ca2+、Mg2+、SO42-和 Cl-五种离子。要除去其中的 Mg2+,可使用氢氧化钠溶液;除去其中的 SO42-,可使用 溶液;除去其中的 Ca2+,可使用 溶液。
(2)在食盐生产的除杂过程中,会带进CO32-,OH-。要同时除去这两种杂质离子,最简便的方法是加入适量的 ,并用 测定溶液的酸碱性。
正确认识相关事物的相同点与不同点,是学好化学的关键之一.我们可用下图来表示事物的异同点.将两种事物的相同点写在两个圆重叠的区域内,每种事物的不同点则写在相应圆中重叠区域以外的部分.请参照下图左侧示例,另外确定一组化学事物,填写在图下面的相应的空格内: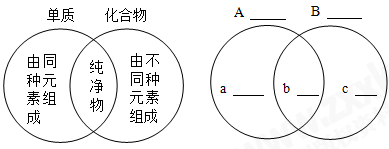
A;B;
a;b;c.
有些化学实验必须严格遵循操作的顺序,请你举出两个这样的实验,并仿照示例填写下表:
| 必须遵循操作顺序的实验 |
先做什么 |
再做什么 |
| 示例:点燃氢气 |
先检验氢气的纯度 |
后点燃氢气 |
(5分)用3个圆圈分别表示C(镁条)、D(氧化铁)、E(氢氧化钡溶液)三种物质,用两圆相切表示两种物质可以发生反应,请回答下列问题:
(1)将C、D、E三个圆画到图中A、B周围适当的位置,并在圆圈中标出三种物质的化学式;
(2)写出E参加反应的化学方程式:_________________;
(3)写出A与B反应的现象___________________。
(7分)首辆会飞的汽车在荷兰问世,该车空中时速可达190公里,加满油后一次最远可飞行约550公里,价格跟豪华轿车差不多。请回答下列问题:
(1)会飞的汽车壳体材料可以是______;(在A、B、C中选填)
A.韧性好、硬度大的锰钢
B.强度好、密度小的铝合金
C.抗腐蚀性好的不锈钢
(2)会飞的汽车工作过程中的能量转化为______;
(3)会飞的汽车工作时产生的尾气中含有一氧化氮,对空气会造成污染,可利用氨气在400℃和催化剂的条件下将其转化为空气中含量最多的一种气体和生活中常见的一种液体.则发生化学反应的方程式是_______________________,该反应的反应物中氮元素的化合价分别为____________。
(4)有人提出用太阳能电池做汽车的动力来源,如果可行,与使用汽油为动力的汽车相比,不仅减少了尾气中___________的排放(两种即可),还可以节约____________。
根据所学知识,完成下列问题:
(1)通常用来制造人造骨的材料是__________。
(2)鱼塘中把水喷向空中的目的是__________。
(3)生活中用来区分软水和硬水的物质是________。
(4)厕所用清洁剂中含有的酸是______。(填溶质的化学式)
(5)如图所示,向盛水的试管中加入少量浓硫酸,由于浓硫酸溶于水_______,使瓶内气压________,在压强差作用下,导致U型管中液面左低右高。
(6)在树木上涂刷含硫黄粉等的石灰浆起到的作用是________。