最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/ mol/L |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中的数据判断该试样的酸碱性为 ,其pH= 。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1
ⅲ C(s)+ O2(g) CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等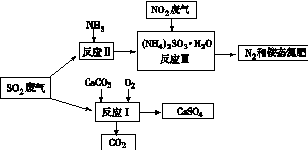
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
锂被誉为“金属味精”,以 LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以 β-锂辉矿(主要成分为 LiAlSi2O6,还含有 FeO、MgO、CaO等杂质)为原料来制 取金属锂。其中一种工艺流程如下: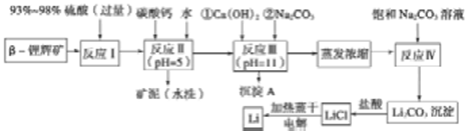
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的 pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示 LiAlSi2O6的组成
(2)反应Ⅱ加入碳酸钙的作用是
(3)写出反应Ⅲ中生成沉淀 A 的离子方程式
(4)反应Ⅳ生成 Li2CO3沉淀,写出在实验室中得到 Li2CO3沉淀的操作名称, 洗涤所得 Li2CO3沉淀要使用( 选填“热水”或“冷水”) ,你选择的理由是
(5 )电解熔融氯化锂生产 锂时,阳极产生的氯气中 会混有少量氧气,原因是
燃料电池具有高的发电效率,因而受到重视。
(1)可用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2的混合气 为正极助燃气,制得在 650℃下工作的燃料电池,完成有关的电池反应式:负极反应2CO+2CO32--4e-=4CO2,正极反应式_
(2)某甲烷一氧气燃料电池的结构如图所示,该电池的两个电极均由多 孔碳制成,以 KOH 溶液为电解质溶液,气体由多孔碳隙逸出并在电极表 面放电,反应后溶液中 K2CO3增 多。写出该电 池的负极反应式
Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的 CO2含量并加以开发利用, 引起了各国的普遍重视。工业上有一种方法是用 CO2生产燃料甲醇。一 定条件下发生反应:CO2(g) +3H2(g) CH3OH(g)+H2O(g)。右图表示该 反应进行过程中能量(单位为 kJ•mol -1)的变化。
(1) 为探究反应原理,现进行如下实验:T1℃时,在体积为 1L 的密闭容器中,充入 1mol CO2和 3mol H2,测得CO2和 CH3OH(g) 的浓度随时间变化如 图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率 v(H2)为mol•L-1•min-1。
(2)温度变为 T2℃(T1 > T2),平衡常数 K (填“增大”、 “不变”或“减小”)。
(3)下列措施中能使 n(CH3OH)/n(CO2)增大的有
A升高温度 B加入催化剂 C将 H2O(g)从体系中分离
D再充入 1molCO2和 3molH2 E.充入 He(g),使体系总压强增大。
Ⅱ.在温度 t℃,某 NaOH 的稀溶液中 c(H+)=10—amol/L,c(OH—)=10—bmol/L,已知 a+b=12,该温度下水的离子积 Kw= ;t 25℃(填“大于”、“小于”或“等于”)。
向该溶液中逐滴加 pH=c的盐酸(t℃),测得混合溶液的部分 pH 如右表 所示。假设溶液混合前后的体积变化 忽略不计,则 c 为
(共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A ;B ;C ;D ;E 。
(2)写出④中反应的离子方程式:。
(3) A溶液中各种离子浓度由大到小的顺序为。
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体。
(1)用NaOH溶液吸收多余的SO2气体,若两者恰好反应生成Na2SO3溶液,则Na2SO3溶液中各微粒间浓度关系正确的是_______。
| A.c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) |
| B.c(Na+)=2c(SO32-) + 2c(HSO3-) + 2c(H2SO3) |
| C.c(Na+) + c(H+)=2c(SO32-) + c(HSO3-) + c(OH-) |
| D.c(H+) + c(HSO3-) + 2c(H2SO3)=c(OH-) |
(2)用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式__________
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:___________________
……
②设计实验方案
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; |
现象:________________________________ 结论:假设1不成立; |
| 步骤2:______________________________ ____________________________________。 |
现象:________________________________ 结论:假设2成立。 |