有关电解质溶液的叙述,下列说法中正确的是
A.0.2 mol·L-1氨水中,c(OH-)与c(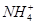 )相等 )相等 |
| B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) |
下列说法正确的是( )
| A.由分子组成的物质中一定存在共价键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子里 |
| D.两个非金属元素原子间不可能形成离子键 |
第三周期元素形成的单质中,属于原子晶体的是( )
| A.金刚砂 | B.金刚石 | C.单晶硅 | D.二氧化碳 |
根据下表给出的几种物质的熔沸点数据,判断下列有关说法中错误的是( )
| NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质B |
|||||
| 熔点/℃ |
810 |
710 |
180 |
-68 |
2300 |
||||
| 沸点/℃ |
1465 |
1418 |
160 |
57 |
2500
|
下面有关晶体的叙述中,不正确的是( )
| A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻10个CO2 |
碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,在下列三种晶体,它们的熔点由高到低的是( )
①金刚石 ②晶体硅 ③碳化硅
A.①③② B.③①② C.②③① D.②①③