对于元素周期表, 下列叙述中不正确的是( )
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 |
| C.在金属元素区域可以寻找制备新型农药材料的元素 |
| D.元素周期表是元素周期律的具体表现形式 |
乙烯雌酚(M)的结构简式如下,它是一种激素类药物,有关叙述中不正确的是( )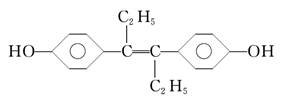
| A.M的分子式为C18H20O2 |
| B.M与NaOH溶液或NaHCO3溶液均能反应 |
| C.1 mol M最多能与7 mol H2发生加成反应 |
| D.1 mol M与饱和溴水混合,最多消耗 5 mol Br2 |
肉桂醛是一种食用香精,广泛应用于牙膏、糖果及调味品中。工业中可通过下列反应制得:
| A.肉桂醛的分子式为C9H8O |
| B.检验肉桂醛中是否残留有苯甲醛:加入酸性KMnO4溶液,看是否褪色 |
| C.1 mol肉桂醛完全燃烧消耗10.5 mol O2 |
| D.肉桂醛中含有的官能团:醛基、碳碳双键 |
amol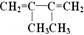 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧生成CO2、H2O、N2,在相同条件下,它们的体积比依次为12:8:1,则a:b为()
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧生成CO2、H2O、N2,在相同条件下,它们的体积比依次为12:8:1,则a:b为()
| A.1 :1 | B.3 :2 | C.2 :3 | D.1 :2 |
已知:乙醇可被强氧化剂氧化为乙酸。 可经三步反应制取
可经三步反应制取 ,发生反应的类型依次是()
,发生反应的类型依次是()
| A.水解反应、加成反应、氧化反应 | B.加成反应、水解反应、氧化反应 |
| C.水解反应、氧化反应、加成反应 | D.加成反应、氧化反应、水解反应 |
用一种试剂就能区分苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液。这种试剂是()
| A.溴水 | B.FeCl3溶液 | C.金属钠 | D.CuO |