下列化学用语不能正确解释相关事实的是
| A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-="==" 2H2O |
B.用电子式表示NaCl的形成过程: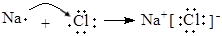 |
| C.向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2+ + S2- ="==" HgS↓ |
| D.汽车尾气系统的催化转化器可降低NO等的排放:2CO+ 2NO 催化剂 2CO2 +N2 |
“地球一小时”熄灯活动,以倡导节能减排理念.下列不能达到节能减排目的是
| A.利用太阳能发电 | B.用家用汽车代替公交车 |
| C.利用化石燃料制造燃料电池 | D.用节能灯代替白炽灯 |
判断下列元素中不属于主族元素的是
| A.磷 | B.钙 | C.碘 | D.铁 |
下列物质中不属于天然高分子化合物的是
| A.纤维素 | B.蛋白质 | C.油脂 | D.淀粉 |
下列化合物能用相应元素的单质直接化合生成的是
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3
| A.②③⑤⑦⑧ | B.①④⑥⑦ | C.②③⑤⑥⑦ | D.④⑥⑦⑧ |
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是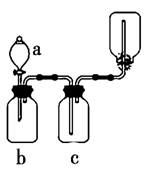
| 选项 |
气体 |
a |
b |
c |
| A |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |
| B |
SO2 |
浓硫酸 |
铜片 |
酸性KMnO4溶液 |
| C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
| D |
CO2 |
稀盐酸 |
碳酸钙 |
浓硫酸 |