现有浓度均为0.1mol/L三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,c(CH3COO-)=c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO23CO2 +N2O。下列关于N2O的说法一定正确的是()
| A.上述反应,每生成lmolN2O,消耗67.2LCO |
| B.等物质的量的N2O和CO2含有相等的电子数 |
| C.N2O只有氧化性,无还原性 |
| D.N2O会迅速与人体血红蛋白结合,使人中毒 |
根据碘与氢气反应的热化学方程式,下列判断正确的是
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole— |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘比1 mol气态碘所含能量多了17.00 kJ |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与CE含有相同类型的化学键
关于下列各实验装置的叙述中,不正确的是()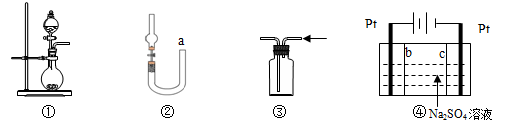
| A.装置①可用于实验室制取少量NH3或O2 |
| B.可用从a处加水的方法检验装置②的气密性 |
| C.实验室可用装置③收集H2、NH3 |
| D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜 |
下列说法正确的是
| A.向某溶液中滴加KSCN 溶液,溶液呈红色,证明存在Fe3+而没有Fe2+ |
| B.铝箔在酒精灯火焰上加热熔化但不滴落,因为铝箔表面氧化铝熔点高于铝 |
| C.向煤中加入适量石灰石,在煤燃烧时最终生成CaSO3,可减少SO2对大气的污染 |
| D.为确证NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3 |