铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
①反应的=kJ·mol-1(用含、 的代数式表示)。
②是反应过程中的中间产物。与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为。
(2)镁铝合金( )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的、 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为。得到的混合物()在一定条件下可释放出氢气。
①熔炼制备镁铝合金()时通入氩气的目的是。
②在 溶液中,混合物 能完全释放出。1 mol 完全吸氢后得到的混合物 与上述盐酸完全反应,释放出的物质的量为。
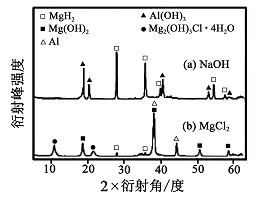
③在 和溶液中,如图混合物 均只能部分放出氢气,反应后残留固体物质的射线衍射谱图如图所示(射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述溶液中,混合物 中产生氢气的主要物质是(填化学式)。
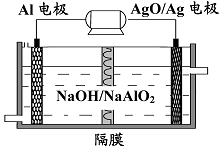
(3)铝电池性能优越,电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为。
化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ•mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2(g) △H3=-41.1kJ•mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
(1)焦炭在过程Ⅰ中做剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l)△H1<0
Si(S)+2ZnCl2(l)△H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g)△H2<0
Si(S)+2ZnCl2(g)△H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g)△H3<0
Si(S)+2ZnCl2(g)△H3<0
i. 反应②的平衡常数表达式为。
ii. 对于上述三个反应,下列说明合理的是。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为。
现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为,1molCS2中含有的π键为个。
(3)Y的中心原子的杂化轨道类型为,分子的立体构型为。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为,该氮化钛的化学式为,氮原子的配位数为。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为g.cm3(NA为阿佛加德罗常数值,只列式计算)。
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是。
(2)该配位化合物的化学式为。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为;EDC4常作电镀液,其中DC 的空间构型是,其中D原子的杂化轨道类型是。
的空间构型是,其中D原子的杂化轨道类型是。
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是,其还原产物是。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。

32.该反应的平衡常数表达式为K=。升高温度,其平衡常数(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为,t5时引起v逆大变化、v正小变化的原因是。