下列说法正确的是()
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B. | 为确定某酸 是强酸还是弱酸,可测 溶液的pH。若pH>7,则 是弱酸;若pH<7,则 是强酸 |
| C. | 用0.2000 mol/L 标准溶液滴定 与 的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中, 浓度:①>④=②>③ |
草酸是二元弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol NaHC2O4溶液中滴加0.01 mol
NaHC2O4溶液中滴加0.01 mol NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是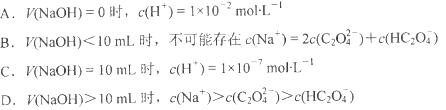
下图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间。下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是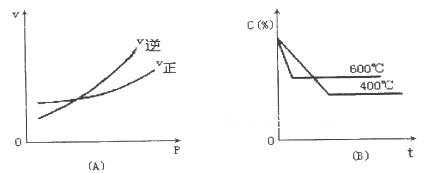
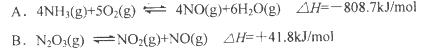
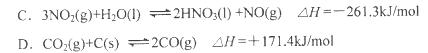
已知常温下: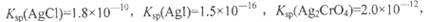
则常温下下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
铜锌原电池如图工作时,下列叙述正确的是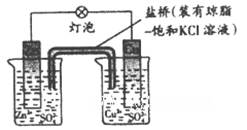
A.正极反应为;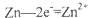 |
B.电池反应为: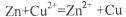 |
| C.在外电路中,电流从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |
下图是一种航天器能量储存系统原理示意图下列说法正确的是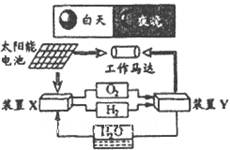
| A.该系统中只存在3种形式的能量转化 |
B.装置Y中负极的电极反应式为: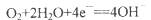 |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |