下列实验不能达到目的的是
| 选项 |
实验操作 |
实验目的 |
| A |
向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 |
验证Ksp(AgCl)> Ksp(AgI) |
| B |
向适量样品溶液中滴加KSCN溶液 |
检验FeSO4溶液是否被氧化 |
| C |
向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 |
检验Na2SO3溶液是否被氧化 |
| D |
向Na2SiO3溶液中通入CO2 |
验证非金属性:碳>硅 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是()
| A.离子半径:C>D>B>A | B.原子序数:d>c>b>a |
| C.原子半径:A>B>C>D | D.单质的还原性:A>B>D>C |
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl。以下对铊的单质及其化合物的性质推断中,不正确的是()
| A.铊是易导电的银白色金属 | B.铊能生成+3价的离子 |
| C.Tl3+的氧化能力比Al3+强 | D.氢氧化铊的碱性比氢氧化铝强 |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、 Z的说法正确的是 ( )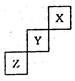
| A.相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B.由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C.ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D.Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
下列递变规律不正确的是()
A:Na、Mg、Al还原性依次减弱 B:C、N、O原子半径依次增大
C:P、S、Cl最高正价依次升高 D:I2、Br2、Cl2氧化性依次增强
下列说法正确的是()
| A.由分子组成的物质中一定存在共价键 |
| B.由非金属元素组成的化合物一定是共价化合物 |
| C.非极性键只存在双原子分子中 |
| D.两个非金属元素原子间不可能形成离子键 |