含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆 )
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
【化学——化学与技术】合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分。请回答下列问题:
(1)右图是工业制硫酸的流程示意图: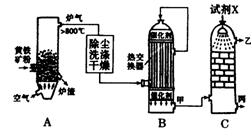
①设备A的名称为。
②试剂X为。
③B设备中热交换器的作用是。
(2)工业制硝酸时,酸吸收塔中的水吸收NO2是放热反应,为使NO2更好被吸收,可采取措施是;工业上用Na2 CO3溶液吸收NO2的化学方程式为。
(3)工业合成氨的化学方程式为,选择天然气做为合成氨原料气的优点是。
研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
①各装置正确的连接顺序为(用a、b、c、d表示)。
②检查整套装置气密性的方法是。
③装置A中常用药品为;装置C中化学药品的作用是。
(2)写出步骤三中发生反应的离子方程式。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
(1)过滤需要的玻璃仪器有。
(2)沉淀Ⅱ的成分为,请用离子方程式表示生成沉淀的过程(写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____,
化学反应原理在科研和生产中有广泛应用。
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。
①该反应的△H0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略
2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: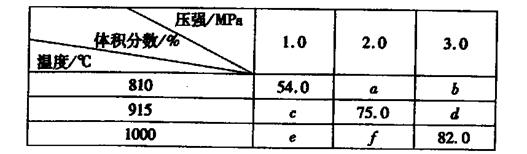
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  HCO3-+OH-的事实。
HCO3-+OH-的事实。
研究银及其化合物具有重要意义。
(l)已知:
Ag2O(s)+2HC1(g)2AgC1(s)+H2O(1)△H1=-324.4 kJ·mo1-1
2Ag(s)+1/2O2(g)Ag2O(s)△H2=-30.6 kJ·mo1-1
H2(g)+C12(g)2HC1(g)△H3=-184.4 kJ.·mo1-1
2H2(9)+O2(g)2H2O(1)△H4=-571.2 l·mo1-1
写出氯气与银生成固体氯化银的热化学方程式________。
(2)美丽的银饰常用Fe(NO3)3溶液蚀刻,写出Fe3+与Ag反应的离子方程式____;要判定Fe(NO3)3溶液中NO3—是否在银饰蚀刻中发生反应,可取的硝酸溶液,然后根据其是否与Ag发生反应来判定。
(3)银锌碱性电池的电解质溶液为KOH溶液,放电时,正极Ag2O2转化为Ag,负极Zn转化为Zn(OH)2,则正极反应式为,负极附近溶液的pH ___(填“增大”、“不变”或“减小”)。
(4)电解法精炼银时,粗银应与直流电源的极相连,当用AgNO3和HNO3混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为____。
【化学一有机化学基础】
M是一种重要的粘合剂,其合成路线如下:
请回答下列问题:
(l)物质C中所含官能团的名称是_________。
(2) H→I的反应类型是_________;检验物质B常用的试剂是_________。
(3) C→D、D→E的反应顺序不能颠倒的原因__________________。
(4)写出与G具有相同的官能团的同分异构体的结构简式:_________。
(5)写出E→F的化学方程式:_______________________________。