下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的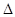 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g) 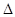 H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |
O2 反应放出115.6 kJ热量,键能如下表所示,则断裂1 mol
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ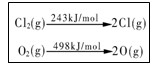
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是
| A.反应①中的能量变化如上图所示 |
| B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |
NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA |
| B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 |
| C.6.8克熔融的KHSO4混中含有0.1NA个阳离子 |
| D.标准状况下,11.2L四氯化碳所含分子数为0.5NA |
下列说法或表达正确的是
| A.乙醇、糖类和蛋白质都是人体必需的营养物质 |
B.NH41的电子式: |
| C.石油是混合物,其分馏产品汽油也是混合物 |
| D.陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。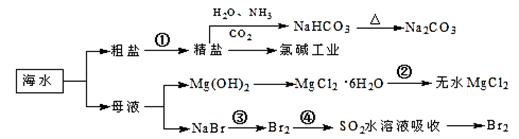
下列有关说法正确的是
| A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.步骤④的作用是达到富集溴的目的 |
| C.过程②中MgCl2·6H2O加热脱水制得无水MgCl2 |
| D.工业上电解熔融精盐的过程称为氯碱工业 |
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
A.产物B的状态只能为固态或液态
B.平衡时,n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量小于Q kJ