实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: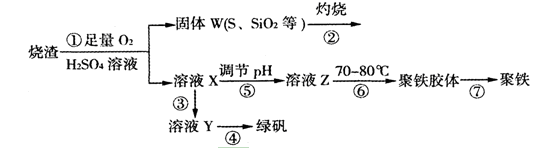
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 ;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)、若A是硫磺,B是气态氢化物,C是造成酸雨的污染物之一,④反应是通一种黄绿色气体,生成D和另一种产物E,D是一种含氧酸,写出反应④的化学反应方程式:_;检验④反应产物E中阴离子所用试剂为:。
(2)、若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写④反应离子方程式 ;利用A的还原性和A转化为氧化物时能放出大量热的性质,工业上常用A来还原一些金属氧化物,写出这类反应在工业上的一个重要应用(用方程式表示)。
(3)、若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液常用于制作印刷电路板,写出该反应的离子方程式 。
对于反应:A+B→C+D+H2O,若已知A是硫酸盐,C是不溶于盐酸的白色沉淀,D是能使湿润的红色石蕊试纸变蓝的气体。请回答:
(1)C属于,D属于。(填字母)
A.电解质B. 非电解质
C. 胶体D. 本身能导电的物质
(2)B属于 ______。(填字母)
A. 单质B. 酸C. 碱D. 盐
(3)该反应(填“是”或“不是”)氧化还原反应。
(4)写出A的电离方程式:_____ _。
(5)写出该反应的化学方程式:___。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
写出下列物质的化学式:
A__________________;H _______________; G_____________;乙______________;
写出下列反应的化学方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。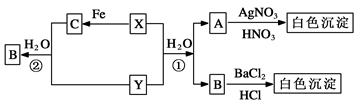
试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2)反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。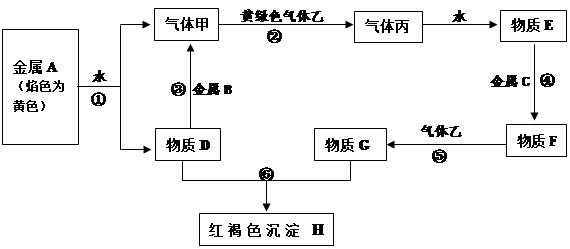
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: F 、 丙 、
(2)写出下列反应离子方程式:
反应①反应③
反应⑤反应⑥