食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长食品保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
C.加热0.1 mol·L-1Na2CO3溶液,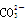 的水解程度和溶液的pH均增大 的水解程度和溶液的pH均增大 |
| D.配制0.01 mol/L的KMnO4 消毒液,所取KMnO4样品受潮,会导致所配溶液浓度偏高 |
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是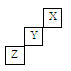
| A.X、Y、Z三种元素中,X的非金属性最强 |
| B.Y的氢化物的稳定性比Z的弱 |
| C.X的单质的熔点比Z的低 |
| D.Y的最高正化合价为+7 |
下列指定反应的离子方程式正确的是
| A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2 + 2Na+ +2OH-=Na2SiO3↓+ H2O |
| C.向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
对于可逆反应:2AB3(g) A2(g)+3B2(g)(正反应吸热)下列图像正确的是
A2(g)+3B2(g)(正反应吸热)下列图像正确的是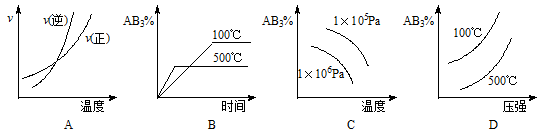
下列有关化学用语表示正确的是
A.CH4分子的球棍模型: |
B.Cl-离子的结构示意图: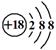 |
C.氟化钠的电子式: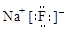 |
D.中子数为146、质子数为92 的铀原子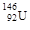 |