一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)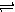 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
下列表示离子化合物形成过程的电子式正确的是()
A. |
B.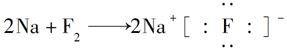 |
C. |
D.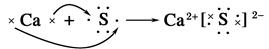 |
A、B两元素的原子序数分别为11和8,二者化合生成离子化合物Z,则下列说法中正确的是()
A.A一定形成+1价的阳离子
B.B一定形成-2价单核阴离子
C.Z一定能与水反应产生B单质
D.Z一定是A2B型化合物
Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是()
| A.KCl | B.Na2S | C.Na2O | D.K2S |
下列说法中正确的是()
| A.难失电子的原子,获得电子的能力一定强 |
| B.易得电子的原子所形成的简单阴离子,其还原性一定强 |
| C.活泼金属与活泼非金属化合,易形成离子键 |
| D.电子层结构相同的不同离子,核电荷数越多,半径越小 |
下列关于化学用语“NH4Cl”的意义,不正确的是()
| A.氯化铵分子中含有一个NH4+和一个Cl- |
| B.氯化铵由N、H、Cl三种元素组成 |
| C.氯化铵晶体由NH4+和Cl-构成 |
| D.氯化铵晶体中阴、阳离子个数比为1∶1 |