【物质结构与性质】
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素
组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的
二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为______,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个σ键, 个π键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。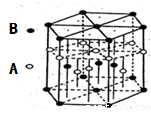
汞蒸气有毒,(1)万一把汞洒出,可以在溅洒有细微汞滴的部位撒一层硫磺粉,这里发生的反应的化学方程式是
___________________________________________________________。
(2)室内有汞蒸气时应进行通风以降低汞蒸气的浓度,这时通风口装在墙的___________(上、下)部效率好。
过氧化氢(H2O2)俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式______________________。
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是:_______________________________。
(3)将Cu放入稀硫酸中不发生反应,但再加入H2O2后,则Cu被溶解。写出离子反应方程式_______________________________________________________。
工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要完成下列问题:
(1)用稀硝酸而不用浓硝酸的原因是_______________________________________________。
(2)从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为__________________________。
某炼油厂油库汽油罐里汽油泄漏,遇一摩托车行驶至附近时,随着一声巨响,瞬间油罐起火爆炸,经及时抢救,大火于20小时后基本扑灭,但消防队队员在火扑灭后仍对油罐喷水6小时,几天后,当地环保部门对炼油厂和当地上空大气监测其污染指数,发现其指标未超过国家有关标准,试根据所学习的化学知识完成以下问题。
(1)该油罐起火原因___________________________________________________________;
(2)灭火后为何还要对油罐喷水_________________________________________________;
(3)市环保部门主要监测大气中哪些有害气体_____________________________________。
今年党中央作出了“西部大开发”的战略决策,在开发的蓝图中有一个“西气东运”的规划,即将西部丰富的天然气资源由管道输送到东部,请用初中学过的化学知识完成下列问题:
(1)天然气的主要成分是(填物质名称)________________。
(2)该主要成分在空气中燃烧的化学方程式是______________________________________。