某溶液只可能含有以下离子中的若干种:H+、NH4+ 、K+、Mg2+、NO2-、CO32-、NO3- ,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)①第一份加足量AgNO3溶液后,有11.68 g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2 g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0 g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100 mL 0.5 mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+ 、NO2-、CO32-,且物质的量之比为5:2:1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
| A.CH3COOH的物质的量 | B.醋酸的电离常数 |
| C.中和时所需NaOH的量 | D.H+的物质的量 |
下列溶液一定现中性的是
| A.PH=7的溶液 | B.c(H+)=10-7mol/L的溶液 |
| C.酸碱恰好完全中和的溶液 | D.c(H+)= c(OH-)=3.5×10-7mol/L的溶液 |
下列事实可证明氨水是弱碱的是
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 |
| B.铵盐受热易分解 |
| C.0.1mol/L氨水可以使酚酞试液变红 |
| D.0.1mol/L氯化铵溶液的pH为5 |
下列方程式书写正确的是
A、H2SO3的电离方程式H2SO3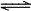 2H++SO32-
2H++SO32-
B、HCO3-在水溶液中的电离方程式:HCO3-+H2O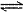 H3O++CO32-
H3O++CO32-
C、CO32-的水解方程式:CO32-+2H2O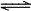 H2CO3+2OH-
H2CO3+2OH-
D、CaCO3的电离方程式:CaCO3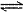 Ca2++CO32-
Ca2++CO32-
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl ⑤NaOH,由水电离出的C(H+)大小关系正确的是
| A.④>③>①=⑤>② | B.①=②>③>④>⑤ | C.②>①>③>④>⑤ | D.④>③>①>⑤>② |