下列图示与对应的叙述相符的是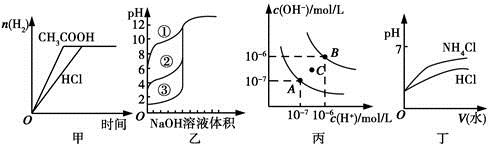
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
硫酸亚铁铵是一种重要的化工原料,以下各组溶液中加入该盐后,选项中各离子数目均没有明显减少的是
| A.Na+ H+ Cl- NO3- |
| B.Na+ Mg2+ Cl- SO42- |
| C.K+ Ba2+ OH- I- |
| D.K+ S2- Br- Cl- |
分类是化学研究中常用的方法。下列分类方法中,不正确的是
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
| A.只有①③ | B.③④⑤⑥ | C.①④⑤⑥ | D.全部正确 |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
| A.①③ | B.②③ | C.②④ | D.①④ |
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g) 2SO2(g)+O2(g) △H=" +Q" kJ/mol 2SO2(g)+O2(g) △H=" +Q" kJ/mol |
| B.向20mL0.5mol·L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.以金属银为阳极电解饱和硫酸铜溶液 Cu2+ + 2H2O=" 2Cu" + O2↑+ 4H+ |
| D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |