在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 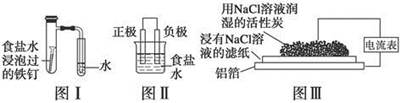
| A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-===Cl2↑ |
| D.图Ⅲ装置的总反应为4Al+3O2+6H2O===4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.标准状况下,11.2LH2O中含有的分子数目为0.5NA |
| B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
| D.标准状况下,22.4L N2和H2混合气中含NA个原子 |
下列四幅图中,小白球代表的是氢原子,大灰球代表的是氦原子。最适合表示同温同压下,等质量的氢气与氦气的混合气体的图示是
A B C D
下列物质分类中,前者包括后者的是
| A.混合物胶体 | B.溶液胶体 |
| C.电解质 化合物 | D.金属氧化物化合物 |
下列图示装置的实验中,操作正确的是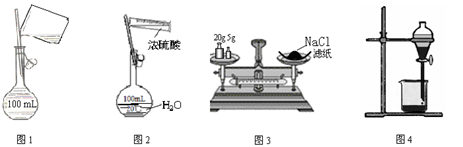
| A.图1配制250mL0.10mol·L-1盐酸 | B.图2稀释浓硫酸 |
| C.图3称量氯化钠固体 | D.图4CCl4萃取碘水的分液操作 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |