在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)  2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是 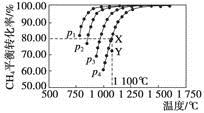
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
下列说法中正确的是
| A.有能量变化的过程一定是化学变化过程 | B.需要加热才能发生的反应是吸热反应 |
| C.化学反应中一定伴有热量的变化 | D.物质发生燃烧的反应一定是放热反应 |
如图,曲线为可逆反应A(g) +2B(g)  2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是
2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是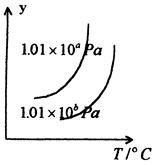
| A.a<b,y轴指B的质量分数 |
| B.a>b,y轴指C的质量分数 |
| C.a<b,y轴指A的转化率 |
| D.a>b,y轴指A的体积分数 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: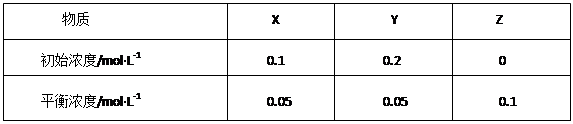
下列说法错误的是()
| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
可逆反应:A2(?)+B2(?) 2AB(?)ΔH=-QkJ/mol,当温度和压强改变时AB物质的量的变化如下图,下列叙述正确的是
2AB(?)ΔH=-QkJ/mol,当温度和压强改变时AB物质的量的变化如下图,下列叙述正确的是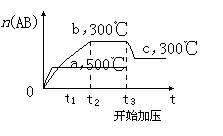
| A.A2、B2及AB均为气体,Q>0 |
| B.AB为气体,A2、B2至少有一种为非气体,Q>0 |
| C.AB为气体,A2、B2有一种为非气体,Q<0 |
| D.AB为固体,A2、B2有一种为非气体,Q>0 |
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:
N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化。
| A.②③⑥⑦ | B.①④⑧ | C.只有①④ | D.只有⑦⑧ |