如图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。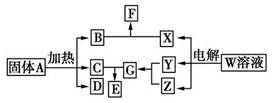
(1)写出X的电子式:________________ ;E中含有的化学键类型是________________。
(2)Z与C以物质的量之比31反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
有A、B、C、D四种含硅元素的物质,它们能发生如下反应:
①C与烧碱反应生成A和水;②A溶液与钙盐溶液反应生成白色沉淀D;
③B在空气中燃烧生成C;④C在高温下与碳反应生成单质B。
根据上述变化,完成下列问题:
(1)写出B、D的化学式:B、D。
(2)写出C与烧碱反应的化学方程式:。写出A溶液与钙盐溶液反应的离子方程式:。
物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为________________________。
(2)若仅A、B在常温下为气体且为化合物, 则回答:
①A的化学式是:A________。
②B生成C的化学方程式为________________________。
③一定条件下碳单质与D反应的方程式为________________________,该反应中D起到的作用是________________.
(3)若A在常温下为固体单质则回答:
①D的化学式是________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L(填“大于”“等于”或“小于”),原因为_________________________________。
某固体混合物可能由K2SO4、NaCl、CuCl2和Na2SO3中的一种或几种组成.依次进行下列五步实验,观察到的现象记录如下:
①取一定量混合物加水溶解得无色透明溶液;
②向上述溶液中滴加足量BaCl2溶液,有白色沉淀生成,将该沉淀洗涤过滤干燥称得质量为a克;
③上述白色沉淀加入稀硝酸充分搅拌后,再次将沉淀洗涤过滤干燥称量,沉淀质量增加;
④往②的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.根据以上实验现象,可以判断出混合物中肯定含有的物质是;肯定不含有的物质是;不能判断混合物中是否含有的物质是.
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1) C和E两种元素相比较,原子得电子能力较强的元素在周期表中的位置为,以下三种说法中,可以验证C和E得电子能力强弱的是(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(2)盐M中含有的化学键类型有;
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(4)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。则负极上的电极反应式为。
(5)已知1molD与水反应放出283.5kJ的热量,试写出D与水反应的热化学反应方程式;
纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构现进行如下各实验:①0.1mol物质A完全转化为酯,需要乙醇0.2mol;②完全中和2.4g物质A,需要消耗0.04molNaOH;③0.1molA能与足量钠反应放出3.36L(标准状况下)氢气;④6.0gA在一定条件下完全分解,生成3.36L(标准状况下)一氧化碳和1.8g水。试计算和推理确定:(1)A的摩尔质量和化学式。(2)A的结构简式。