一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
| A.等于5 s | B.大于10 s | C.等于10 s | D.小于10 s |
金属元素铊的相关信息如图所示。下列有关卡片信息解读正确的是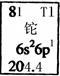
| A.铊元素的质量数是81 | B.铊原子的电子数为3 |
| C.铊原子的相对原子质量是204.4 | D.铊的金属性比铝的金属性强 |
某有机物的结构如图:它的同分异构体中属于芳香酸的有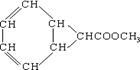
| A.8种 | B.10种 | C.12种 | D.14种 |
某有机物具有下列性质:能发生银镜反应,滴入石蕊试液不变色,加入少量碱液并滴入酚酞试液,共煮后红色消失。原有机物是下列物质中的
| A.甲酸 | B.乙酸甲酯 | C.乙醛 | D.甲酸乙酯 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.0.1 mol组成为C2H6O的有机物,所含C—H键数目不一定为0.5NA |
| B.8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA |
| C.0.1 mol N2与0.3 mol H2在密闭容器中,在催化剂作用下充分反应,生成氨分子数为0.2NA |
| D.标准状况下,22.4 L HF所含的分子数目为NA |
今有乙酸和乙酸甲酯的混和物中,测得含碳的质量百分数为X,则混和物中氧的质量百分数为
| A.(1-X)/7 | B.6(1-X)/7 | C.1-7X/6 | D.无法计算 |