在一固定容积的密闭容器中,可逆反应

 达到平衡的标志是( )。
达到平衡的标志是( )。
A. |
B.单位时间内  键断裂,同时6mol 键断裂,同时6mol 键断裂 键断裂 |
C. |
| D.反应混合物各组分的物质的量浓度还在改变 |
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有( )
| A.8种 | B.14种 | C.16种 | D.18种 |
有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是( )
| A.甲分子中C的质量分数为40% |
| B.甲在常温常压下为无色液体 |
| C.乙比甲的沸点高 |
| D.乙和甲的最简式相同 |
在一定条件下,既可以发生氧化反应,又可以发生还原反应,还可以和羧酸发生酯化反应的是( )
| A.乙醇 | B.乙醛 | C.乙酸 | D.葡萄糖 |
乳糖是一种二糖,可以水解生成葡萄糖和半乳糖。半乳糖和葡萄糖互为同分异构体,则乳糖的分子式为( )
| A.C6H12O6 |
| B.C18H30O15 |
| C.C12H24O12 |
| D.C12O22O11 |
某期刊封面上有如下图所示的一个分子的球棍模型图。图中:“棍”代表单键或双键;
不同颜色的球代表不同元素的原子。该模型图可代表一种( )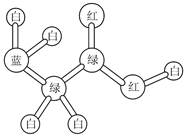
| A.卤代羧酸 | B.酯 | C.氨基酸 | D.醇钠 |