25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种浓度相同溶液,pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3混合反应后:
c(Na+)>c(HCO3-)>c(CH3COO-)>c(OH-)>c(H+)
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
下列对有机物的认识错误的是
| A.淀粉、纤维素、蔗糖都是糖类,水解的最终产物都是葡萄糖 |
| B.蛋白质是生命活动的基础物质,水解的最终产物都是氨基酸 |
| C.含有醛基的有机物能跟银氨溶液发生银镜反应 |
| D.烃或烃的含氧衍生物分子中的氢原子数一定是偶数 |
下列有关物质组成与结构表示方法不正确的是
A.HClO 电子式: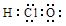 |
B.CH4比例模型: |
| C.乙炔结构简式:HC≡CH | D.质子数55,中子数82的原子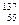 Cs Cs |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.22.4 L C2H4气体,一定含有分子数为NA |
| B.标准状况下,2.24 L C5H12一定含有分子数为0.1 NA |
| C.常温常压下,14 g CO和N2的混合气体中,含有原子数为NA |
D.1 L 1 mol /L NH4Cl溶液中含有NH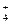 数为NA 数为NA |
化学与工农业生产和人类生活密切相关。下列说法中错误的是
| A.晶体硅是良好的半导体材料,是信息技术的关键材料 |
| B.开发利用风能、太阳能、生物质能等新能源符合“低碳经济”战略 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.酸雨就是pH <7的雨水,主要是由大气中的SO2、NO2等造成的 |
配制250ml 0.10mol/L的NaOH溶液时,下列实验操作会使得配制的溶液浓度偏大的是
| A.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| B.在容量瓶中进行定容时,仰视刻度线 |
| C.在容量瓶中进行定容时,俯视刻度线 |
| D.定容且把容量瓶倒置摇匀后,发现液面下降,又补充了水 |