浓硝酸、稀硝酸都具有强氧化性,某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器的装置已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。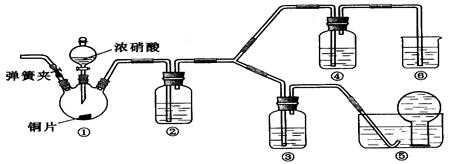
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应
2NO2 + 2NaOH === NaNO3 + NaNO2 + H2O
(1)浓硝酸与NO反应的氧化产物与还原产物的物质的量之比为
(2)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(3)滴加浓硝酸之前的操作依次是检验装置的气密性,加入药品,打开弹簧夹后
(4)装置①中发生反应的化学方程式是
装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论所依据的实验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
粗颗粒 |
|||
| ③ |
||||
| ④ |
298 |
(2)实验①中CO2质量随时间变化的关系见右图: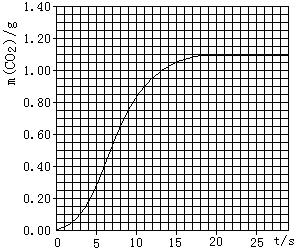
依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在6s-11s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程,结果保留两位小数)。
实验室用如图所示的装置制取乙酸乙酯.
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
(16分)实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)两套装置中的A、B处都需加热,A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,B中反应的化学方程式为。
(3)若按乙装置进行实验,则B管中应装,B中反应的化学方程式为。
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式。
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是。
(共15分)I(1)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察,定性比较得出结论。观察两同学的方案,你认为(填“甲”或“乙”)更合理。理由是。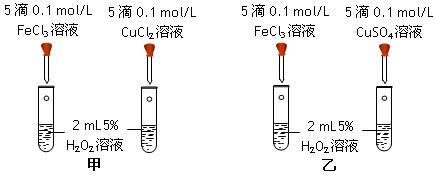
(2) 丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
(10分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗硫酸为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(3)上述操作步骤中两处错误分别是,
(请指出具体错误)。由此造成的测定结果分别是, (填偏高、偏低或无影响)。
(4)某次滴定时的滴定管中的液面如图,则其读数为mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会(填偏高、偏低或无影响)。
(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.45 |
| 第二次 |
20.00 |
4.00 |
29.05 |
请计算待测烧碱溶液的浓度为mol/L。