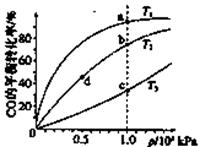
已知反应2H2(g)+CO(g)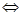 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
| 平衡常数 |
温度/℃ |
||
| 500 |
700 |
800 |
|
| K |
2.50 |
0.34 |
0.15 |
A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
简单原子的原子结构可用下图形象地表示: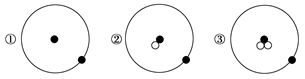
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是
a.①②③互为同位素
b.①②③由同种元素构成
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
| A.a、b、f | B.b、c、d | C.a、d、e | D.a、e、f |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是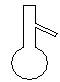
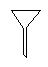
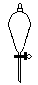
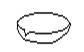
| A.蒸馏、蒸发、分液、过滤 | B.蒸馏、过滤、分液、蒸发 |
| C.分液、过滤、蒸馏、蒸发 | D.过滤、蒸发、分液、蒸馏 |
下列试剂的保存方法不正确的是
| A.NaOH溶液保存在配有玻璃塞的细口瓶中 |
| B.金属钠通常密封保存在煤油中 |
| C.氯水通常保存在棕色细口瓶并置于阴凉处 |
| D.在盛液溴的试剂瓶中加水,形成“水封”,以减少溴挥发 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| D.从海水中制取氯气的过程涉及氧化还原反应 |
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)=mol·L-1,c(CH3COOH)=mol·L-1;
(3)CH3COOH的电离平衡常数Ka=(用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是