在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
| A.c (Na+)=c(CH3COO-)+c(CH3COOH) |
| B.c(H+)=c(CH3COO-)+c(OH一) |
| C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
| D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
下列实验所对应的离子方程式正确的是
| A.向NAAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3- |
| B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+ |
| C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:BA2++2HCO3-+2OH-===BACO3↓+CO32-+2H2O |
| D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-===Fe4[Fe(CN)6]2↓ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NAOH溶液:K+、NA+、SO42-、CO32- |
| B.0.1 mol·L-1 NA2CO3溶液:K+、BA2+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN- |
| D.C(H+)/C(OH-)=1×1014的溶液:CA2+、NA+、ClO-、NO3- |
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏高的原因可能是
| A.容量瓶事先未烘干 |
| B.定容时俯视观察液面 |
| C.未用蒸馏水洗涤烧杯 |
| D.定容后,摇匀时有少量液体流出 |
同物质的量浓度的KCl、CACl2、AlCl3三种溶液的体积比为3:2:1,这三种溶液中Cl﹣浓度之比是
| A.3:2:1 | B.1:2:3 | C.1:1:1 | D.2:3:1 |
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NAOH溶液的过程: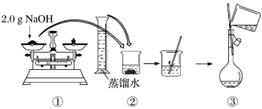
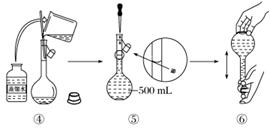
该同学的错误步骤有
| A.1处 | B.2处 | C.3处 | D.4处 |