工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。
I.探究制取NH3的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。
| 试剂组合序号 |
固体试剂 |
NH3体积(mL) |
|
| a |
6.0gCa(OH)2过量 |
5.4gNH4Cl |
1344 |
| b |
5.4g(NH4)2SO4 |
1364 |
|
| c |
6.0gNaOH过量 |
5.4gNH4Cl |
1568 |
| d |
5.4g(NH4)2SO4 |
1559 |
|
| e |
6.0gCaO过量 |
5.4gNH4Cl |
1753 |
| f |
5.4g(NH4)2SO4 |
1792 |
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。
(2)A中反应的离子方程式为__________________________
(3)D装置的作用有:_____________、____________、_____________。
(4)D装置中的液体还可换成 (填序号)。
A.H2OB.CCl4C.浓H2SO4D.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是___________.
甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)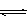 CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)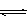 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。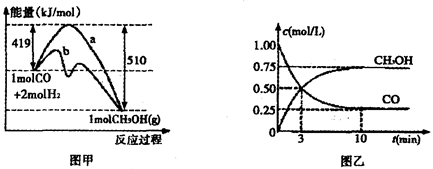
在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g)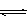 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。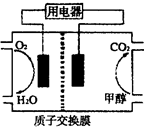
①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
请结合火柴燃烧过程中观察到的现象,探讨该过程中可能发生的主要反应,并尝试写出它们的化学方程式。
人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉在淀粉酶作用下或在酸性环境下可以水解成葡萄糖:
(C6H10O5)n+nH2O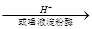 nC6H12O6
nC6H12O6
(1)已知葡萄糖化学式是C6H12O6,试推导葡萄糖分子的结构简式,已知多元醇与新制Cu(OH)2悬浊液混合可形成绛蓝色溶液。
(2)实验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
误食亚硝酸钠会造成人畜中毒。亚硝酸钠像食盐一样有咸味,但有很强的毒性。实验证明,它还有很强的氧化性。
(1)已知亚硝酸钠溶液能和氢碘酸发生反应,反应后溶液呈浅黄色,同时产生一种无色气体,该气体遇空气即变为红棕色,请写出反应的化学方程式。
(2)现有两种粉末,一种为亚硝酸钠,另一种为氯化钠,请用两种方法鉴别它们。
为什么由不同种元素的原子生成的PCl5分子为非极性分子,而由同种元素的原子形成的O3分子却是极性分子?