氮的化合物是中学化学的重要物质,与人类生活密切相关。
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示: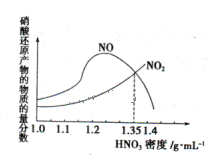
请写出铁与密度为1.35 g.m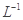 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.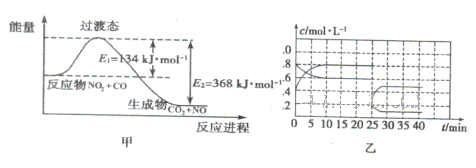
(4)已知NO2和N2O4可以相互转化:2NO2(g)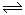 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO2表示的平均反应速率v(NO2)= ;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 | C.降低温度 | D.再加入一定量的NO2 |
CO2的摩尔质量是;2molCO2的质量是;它在标准状况下所占的体积约为,所含的分子数目约为;所含氧原子的数目约为。
(共8分)
在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2的变化的曲线是。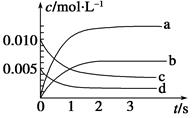
(2)求 2 s末用氧气表示的平均反应速率v(O2)=
(3)求达平衡时NO的转化率为
(4)能说明该反应已经达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离出NO2气体 b.增大O2的浓度
(共10分)
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。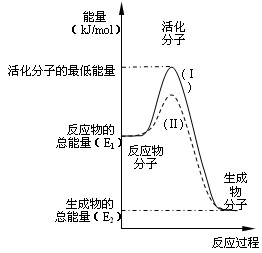
①图中所示反应是(填“吸热”或“放热”)反应,该反应(填“需要”、“不需要”或“不一定”)加热,该反应的△H =(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________________________________。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ ①C(s)+O2(g) === CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:②C(s)+H2O(g) === CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
③2CO(g)+O2(g) === 2CO2(g) ΔH3<0④2H2(g)+O2(g) === 2H2O(g) ΔH4<0
请回答下列问题:
①判断两种途径放热:途径Ⅰ放出的热量________途径Ⅱ放出的热量(填“大于”、“等于”或“小于”)。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_________________________________。
③由于制取水煤气的反应里,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________能量才能转化为生成物,因此其反应条件为________。
(3)已知:Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g) === 2Fe3O4(s)+CO2(g)ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g)ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:______________________________________。
(1)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________,该混合气体的平均摩尔质量为___________。
(2) 同温同压下,质量相同的五种气体:① CO2② H2③ O2④ CH4⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
(3)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为____________, 物质的量浓度为_________________。
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_________________L。
(4)该气体在标准状况下的密度为_______________ g/L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。