(6 分) 早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置测定某赤铁矿石中氧化铁的质量分数。请按要求回答问题: 
(1)实验中玻璃管里氧化铁粉末的颜色变化是 。
(2)实验开始时先向大玻璃管中通入 CO,一段时间后再加热的原因是 。
(3)现用足量一氧化碳与 12g赤铁矿石充分反应后,盛石灰水的装置质量增重 8.8g(矿石中杂质不参与反应,生成的气体全部被吸收) 。计算赤铁矿石中氧化铁的质量分数。
称取氯化钠和氯化钙的固体混合物14g,放入烧杯中,加入100g碳酸钠溶液恰好完全反应。待反应完全后过滤,称得滤液的总质量为104g。求:
(1)固体混合物中氯化钙的质量是多少?
(2)反应后所得溶液的溶质质量分数是多少?
为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:
(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
称取一定质量的锌粉与质量分数为20%的稀硫酸若干克混合恰好完全反应,生成氢气1.0g。(反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑)计算:
(1)称取锌粉的质量(2)反应后溶液的总质量。
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某化学兴趣小组对蓝色固体的成分进行了定性探究,得知其为Cu(OH)2和CuCO3的混合物。
(1)蓝色固体中含有CuCO3,原因是:(用化学方程式表示);蓝色固体中含有Cu(OH)2,原因是:Na2CO3溶液呈性(选填“酸”、“中”或“碱”)。
(2)已知:Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,且各生成对应的两种氧化物。设蓝色固体的组成为aCu(OH)2•bCuCO3,该小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。
①写出CD段发生反应的化学方程式:
。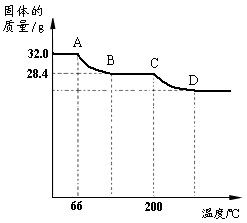
②根据右图计算出a︰b的值。(写出计算过程,计算结果用最简整数比表示)
③D点对应纵坐标的值为。
生铁和钢都是铁的合金,生铁中碳的含量在2.0%--4.3%之间,钢中的含碳量在0.03%--2.0%之间。将一块质量为8.5克的铁的合金放入锥形瓶中,加入98克稀硫酸,恰好使铁合金中的铁完全反应(碳不溶于稀硫酸,铁合金中其他元素含量很低,可以忽略不计),测得生成氢气的质量为0.3克。请通过计算回答:该铁合金是生铁还是钢?