仅用下表提供的仪器和药品,就能达到相应实验目的的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
托盘天平(带砝码)、250mL容量瓶、量筒、烧杯、药匙、玻玻棒 |
NaOH固体、蒸馏水 |
配制250mL一定物质的量浓度的NaOH溶液 |
| B |
分液漏斗、锥形瓶、导管及橡皮塞 |
稀硫酸、碳酸钠、硅酸钠溶液 |
证明非金属性;S>C>Si |
| C |
碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶 |
己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸 |
测定稀盐酸的物质的量浓度 |
| D |
铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞 |
氯化铵 |
制取氨气 |
同周期有下列电子排布式的原子中,第一电离能最小的是
| A.ns2np3 | B.ns2np4 |
| C.ns2np5 | D.ns2np6 |
下面元素周期表中全部是金属元素的区域为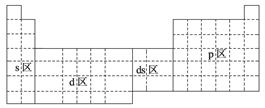
| A.只有s区 | B.只有d区 |
| C.s区、d区和ds区 | D.d区和ds区 |
下列说法正确的是
| A.分子晶体中一定存在分子间作用力,不一定存在共价键 |
| B.分子中含两个氢原子的酸一定是二元酸 |
| C.含有金属离子的晶体一定是离子晶体 |
| D.元素的非金属性越强,其单质的活泼型一定越强 |
已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是
| A.3s23p3 | B.4s24p1 | C.4s2 | D.3s23p5 |
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。
下列关于水的说法正确的是
| A.水是弱电解质 | B.可燃冰是可以燃烧的水 |
| C.氢氧两种元素只能组成水 | D.0℃时冰的密度比液态水的密度大 |