X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子最外层电子排布式为nsnnpn |
| Y |
Y是空气中含量最高的元素 |
| Z |
Z是地壳中含量最高的金属元素 |
| W |
W的单质是常见的半导体材料 |
(1)Y位于元素周期表的 周期 族,Y与W的气态氢化物较稳定的是 (写化学式)
(2)Z的单质与W的单质相比熔点较高的是 (写化学式);Z与W原子半径较大的是 (写化学式)
(3)X的一种氧化物XO2分子中σ键与∏键数目之比为
(4)X的第一电离能比W的 (填“大”或“小”)
(5)写出X的单质与Y的最高价氧化物水化物的浓溶液在加热的条件下反应的化学方程式:
(6)已知2.7gZ单质与足量Y单质反应,放出31.8kJ的热量,请写出此反应的热化学方程式: 。
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。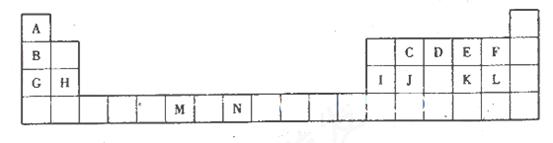
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应: (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22. 4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0-ls内该反应的平均反应速率为__________________。
(2)O2的平衡浓度c (O2)=____________________________;
(3) 4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是________(用百分数表示)。
(5)若将平衡混台气体中SO3的5%通入过量的BaCl2溶液,生成沉淀_______克(计算结果保留一位小数)。
A.、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)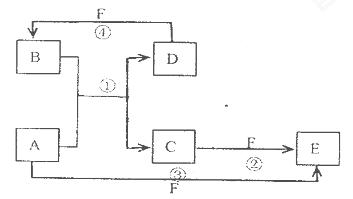
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电予数D是A的2倍,F的浓溶液与A D反应都有红棕色气体生成,则A为___________________,
反应④的化学方程式为____________________________________.
(2)若A为常见的金属单质,D F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________________.
(3)若A.D.F都是短周期非金属元素单质,且A.D所含元素同主族,A.F所含元素同周期,则反应①的化学方程式为________________________.
(共10分)丙烯醇(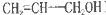 )是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)丙烯醇的分子式为__________;丙烯醇中含有的官能团的名称是__________。
(2)0.3mol丙烯醇与足量金属钠反应,能生成标准状况下的氢气_________ L。
(3)写出丙烯醇与溴水反应的化学方程式____________________________
反应类型为____________________
(4)丙烯醇与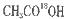 发生酯化反应的化方程式为:________________________________酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化舍物,其结构简式为____________________________。
发生酯化反应的化方程式为:________________________________酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化舍物,其结构简式为____________________________。