三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是
| A.该物质中磷元素的化合价为+3 |
B.该物质分子中含有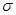 键和 键和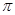 键 键 |
| C.该物质的熔、沸点比食盐高 |
| D.该物质22g含硫原子的数目约为1.806×1023 |
有两份铝屑,第一份与足量的稀盐酸反应,第二份与足量的NaOH溶液反应,产生氢气的体积之比为1:2,第一份铝屑与第二份铝屑的质量之比为
| A.1:2 | B.1:1 | C.1:3 | D.2:1 |
下列有关试剂的保存方法,错误的是
| A.浓硝酸保存在无色玻璃试剂瓶中 |
| B.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中 |
| C.少量的钠保存在煤油中 |
| D.保存氯化亚铁一般要加入少量的铁粉防止变质 |
向CuO和Fe的混合物中加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,再向滤液中插入一枚铁钉,发现铁钉无任何变化。根据上述现象判断下列结论正确的是
| A.不溶物一定是Cu | B.不溶物中一定含有铜,但不一定含有铁 |
| C.不溶物一定是Fe | D.溶液中一定含有Fe2+,但不一定含有Cu2+ |
检验试管中盛有的少量白色固体是铵盐的方法是
| A.加NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.将固体加热,将产生的气体通入紫色石蕊试液,看是否变红 |
| C.加水溶解,用pH试纸测溶液的酸碱性 |
| D.加入NaOH溶液,加热,再滴入酚酞试液 |
物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有
①3FeO + 10HNO3= 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4 (浓) = CO2+ 2SO2+ 2H2O
③8NH3 + 3Cl2 = 6NH4Cl + N2
④2Na2O2 + 2H2O =" 4NaOH" + O2
| A.①② | B.①④ | C.③④ | D.全部 |