下表中的实验操作能达到实验目的或能得出相应结论的是( )
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。 |
除去Mg(OH)2样品中的Ca(OH)2 |
| B |
取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸 酸化的AgNO3溶液。 |
检验KC1O3中的氯元素 |
| C |
向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。 |
说明原溶液中一定含有CO32-或SO32- |
| D |
向盛有1mL 0.01lmol·L-1AgNO3溶液的试管中滴加5滴0.0lmol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加0.01 mol·L-1 NaI溶液,产生黄色沉淀。 |
常温下, Ksp(AgCl)>Ksp(AgI) |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可放出热量,则该反应的△H<0 |
| B.常温下浓硫酸与铝不反应,可用铝槽车运输 |
C.二氧化碳的电子式: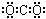 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小 |
下列说法正确的是
| A.需要加热的化学反应都是吸热反应 |
| B.水力发电是将化学能转化为电能的过程 |
| C.食醋、纯碱、食盐分别属于酸、碱、盐 |
| D.生铁、不锈钢、青铜都属于合金 |
下列反应中不属于放热反应的是
| A.酸碱中和反应 |
| B.NH4Cl晶体与Ba(OH)2•8H2O晶体反应 |
| C.镁条的燃烧 |
| D.活泼金属与酸的反应 |
下列变化中,属于放热反应的是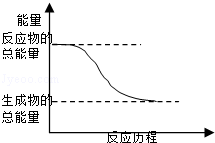
| A.H2O(g)═H2O(l)△H=﹣44kJ/mol |
| B.2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
| C.能量变化如图所示的化学反应 |
| D.形成化学键时放出能量的化学反应 |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)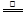 CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
| A.△H2>△H3 | B.△H1<△H3 |
| C.△H1+△H3 =△H2 | D.△H1+△H2>△H3 |