锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
| 实验步骤(不要求写出具体步骤) |
预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, |
|
| |
|
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 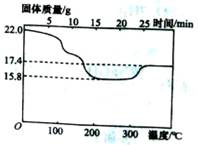
某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: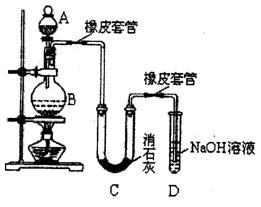
(1)A仪器的名称是,所盛试剂是。
(2)漂白粉将在U型管中产生,其化学反应方程式是。
(3)有同学建议在两个橡皮套管内的两段玻璃导管管口应尽量紧靠,原因是。
(4)此实验所得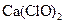 产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了氯酸钙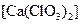 ,为避免此副反应的发生,可采取的措施是;
,为避免此副反应的发生,可采取的措施是;
②试判断另一个副反应是(写出此反应方程式)。
为避免此副反应发生,可采取的措施是。
化学是一门以实验为基础的自然学科,进化化学实验时要采取正确的实验操作,注意实验安全。
(1) 在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种。
在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种。
(2)下列实验能达到目的的是。
| A.在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸 |
| B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜加快反应速率 |
| C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度 |
| D.加入盐酸以除去硫酸钠中的少量碳酸杂质 |
E.制取Fe(OH)2时,吸取除去氧气NaOH溶液的胶头滴管的末端插入FeSO4溶液中,再注入NaOH溶液
(3)某化学小组设计如图装置完成一组实验: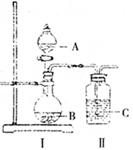
A中装硝酸,B中装石灰石,C中装漂白粉溶液,现象是装置II中产生白色沉淀。他得出酸性:HNO3>H2CO3>HClO。由此得出元素非金属:N>C>Cl。你认为他得出的结论是否正确?答:(填“正确”或“不正确”)。理由是。
(4)有些同 学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)
学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③某同学设计的下列滴定方式,最合理的是(夹持部分略去)(填字母序号)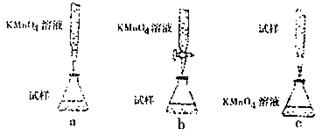
某校课题研究小组的同学们为了探究“二氧化碳在什么条件下和过氧化钠反应”。甲同学设计了如下的实验探究:
实验一:干燥的二氧化碳和过氧化钠的反应:
在干燥的试管Ⅱ中装入Na2O2,立即塞紧该试管的试管塞(试管塞上两导气管上的K1和K2处于关闭状态),在试管Ⅰ内装入试剂X后,按图连好装置,打开K1和K2,通入CO2。几分钟后,将带火星的木条插入试管Ⅲ中,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验二:潮湿的二氧化碳和过氧化钠的反应:
在试管Ⅰ内装入试剂Y,其他操作同实验一,观察到木条复燃,且Ⅱ中的淡黄色变为白色。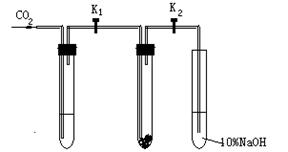
ⅠⅡⅢ
试回答下列问题:
(1)在实验一中,试剂X是,其作用是。
(2)在实验二中,试剂Y是。
(3)在装入Na2O2后,立即塞紧试管塞,且关闭K1和K2的目的是
;
(4)试管Ⅲ中的NaOH溶液的作用是。
(5)根据上述两个对比实验的现象,甲同学得到的结论是:
。
12分) 已知有以下物质相互转化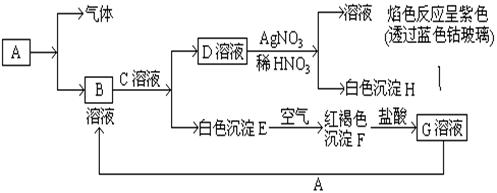
试回答: (1)写出化学式B,DEF
(2)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 _______。
(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。