(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3•10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
(4)部分共价键键能数据如下表:
| 键 |
H-H |
N-H |
N-N |
N=N |
N≡N |
| 键能/kJ•mol-1 |
436 |
391 |
159 |
418 |
945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| |
分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
FeS饱和溶液中存在溶解平衡:FeS(s)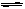 Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为。
牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s)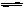 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________。
根据以上原理请你提出另外一种促进矿化的方法_______________________。
在含有Cl-.Br-.I-的溶液中,已知其浓度均为0.1 mol/L,而AgCl.AgBr.AgI的浓度积(mol2/L2)分别为:1.6×10-10.4.1×10-15.1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液并充分搅拌时,首先析出的沉淀是_______________,最后析出的沉淀是_________;当AgBr沉淀开始析出时,溶液中Ag+的浓度是___________________
向含有AgI的饱和溶液中分别加入下列物质,请就溶液中碘离子浓度的变化做出回答。(1)加入固体AgNO3:________________________________________
(2)若改加更多的AgI固体:________________________________________
(3)若改加AgBr固体:________________________________________
工程塑料ABS树脂(结构简式如下)合成时用了三种单体。
 ABS:-{-CH2-CH-CH2-CH=CH-CH2-CH2-CH-}-n
ABS:-{-CH2-CH-CH2-CH=CH-CH2-CH2-CH-}-n
CN C6H5
式中- C6H5是苯基。这三种单体的结构简式分别是:
、 、