已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是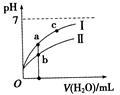
| CH3COOH |
HClO |
H2CO3 |
| Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
已知反应 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
在 反应中,表示该反应速率最快的是( )。
反应中,表示该反应速率最快的是( )。
下列方程式属于水解反应方程式的是( )。
对“ ”的理解正确的是( )。
”的理解正确的是( )。
| A.说明AgCl没有完全电离,AgCl是弱电解质 |
| B.说明溶解的AgCl已完全电离,AgCl是强电解质 |
| C.说明Ag+与Cl-的反应不能完全进行到底 |
| D.说明Ag+与Cl-的反应可以完全进行到底 |
已知298K时下述反应的有关数据:
