开发新型储氢材料是氢能利用的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键 (填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为 ,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为 。
②与(HB=NH)3互为等电子体的分子为 (填分子式)
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为 。
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为 ,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为 。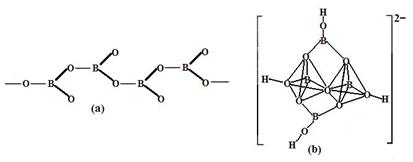
(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为 。
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是 。
③铜的单质中按ABCABC……方式堆积,设铜原子半径为a pm,则该晶体的密度为 g/cm3(阿伏伽德罗常数值为NA)
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:试回答下列问题: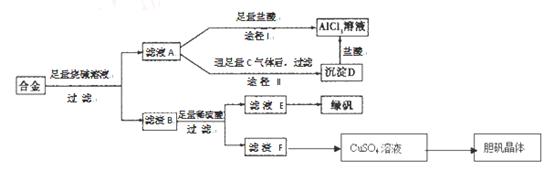
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称)。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。
写出A经途径Ⅱ生成D的离子方程式。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
(1)写出A、B、C、D、E、F的化学式:
B.________;C.________;D.________;E.________;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
E→B: _______________________________________________,
C→F: ____________________________________________________,
F→C: ____________________________________________________。
(3)下列实验方案中,不能准确测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A. 取a克混合物充分加热,减重b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;7在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体g。
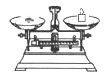
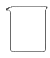
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母)。
| 名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
| 仪器 |
 |
 |
 |
 |
 |
 |
| 序号 |
a |
b |
c |
d |
e |
f |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示: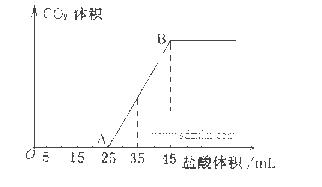
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。