25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
| A.I和II中H2O的电离程度不相等 |
| B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小 |
| C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量 |
| D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+) |
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是( )
| A.150 mL 1 mol·L-1的NaCl溶液 | B.75 mL 2 mol·L-1 NH4Cl溶液 |
| C.150 mL 2 mol·L-1的KCl溶液 | D.75 mL 1 mol·L-1的FeCl3溶液 |
科学家已发现一种新型氢分子,其化学式为H3。在相同条件下,等质量的H3和H2具有相同的是 ()
| A.原子数 | B.分子数 | C.体积 | D.物质的量 |
下列变化一定需要加入还原剂才能实现的 ( )
A.HCO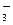 →CO2 →CO2 |
B.HCl Cl2 Cl2 |
C.F eCl3 eCl3 FeCl2 FeCl2 |
D.Mn2+ MnO4- MnO4- |
在过滤、蒸发和配制一定物质的量浓度溶液的实验中都用到的玻璃仪器的是 ( )
| A.铁架台 | B.烧杯 | C.玻璃棒 | D.酒精灯 |
纳米材料在工农业生产和日常生活中应用越来越广,下列分散系中分散质粒子直径与纳米粒子具有相同数量级的是 ()北京四中网校
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |