25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。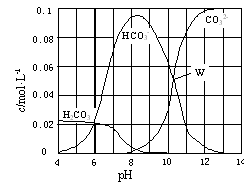
下列有关溶液中离子浓度关系叙述正确的是 ( )
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
下列物质中,含有非极性共价键的是
| A.N2 | B.CO2 | C.NaOH | D.CH4 |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是:
| A.R一定是第VIIA族元素 | B.R的最高价氧化物为RO3 |
| C.R的气态氢化物能燃烧 | D.R的气态氢化物易溶于水显碱性 |
下列说法正确的是
A.NaCl固体中含有共价键 B.CO2分子中含有离子键
C.12 6C、13 6C、14 6C是碳的三种核素 D.16 8O、17 8O、18 8O含有相同的中子数
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是
| A.元素X:它的原子中M层比L层少2个电子 |
| B.元素Z:位于元素周期表中的第三周期第ⅢA 族 |
| C.元素Y:它的二价阳离子核外电子总数与氩原子相同 |
| D.元素W:它的焰色反应颜色呈紫色 |