下列有关实验的描述正确的是
| A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
| B.中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥 或用待装液润洗后方可使用 |
| C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中 |
| D.向含有FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热蒸干,可得到纯净的FeCl3固体 |
下列化学用语书写正确的是:
A.氯原子的结构示意图: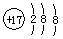 |
B.作为相对原子质量测定标准的碳核素为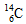 |
C.氯化镁的电子式: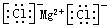 |
D.HClO的结构式为H-Cl-O |
下列过程中需要加快化学反应速率的是:
| A.钢铁腐蚀 | B.食物腐败 | C.工业合成氨 | D.橡胶老化 |
俄国化学家门捷列夫为化学的发展做出过十分重要的贡献,在前人研究的基础上,他于1869年提出了:
| A.原子学说 | B.分子学说 | C.等电子体学说 | D.元素周期律 |
下列说法正确的是()
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为: 4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAI(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系: |
c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
已知:H2(g)+ O2(g)=H2O(1)△H=-285.8kJ·mol-1
O2(g)=H2O(1)△H=-285.8kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H="-890.3" kJ·mol-1
现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(1),共放出热精3242.5 kJ,则原混合气体中H2和CH4的物质的量之,比是()
| A.1:1 | B.1:3 | C.1:4 | D.2:3 |