几种短周期元素的原子半径及主要化合价如下表,由此可知 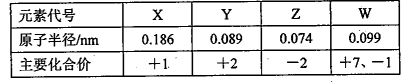
| A.X、Y元素的金属性:X<Y |
| B.X、Z形成的化合物中一定不含共价键 |
| C.W的最高价氧化物的水化物是一种强酸 |
| D.离子半径:X+>Z2- |
由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生 物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125m
物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125m L小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
L小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质改变 |
B.水分子中氢氧键发生改变 |
| C.水分子由极性分子变成了非极性分子 | D.水分子间结构、物理性质改变 |
设阿伏加德罗常数为NA,则下列说法正确的是
| A.17g羟基(-OH)所含有的电子数是10NA |
| B.常温常压下,7gCnH2n中含氢原子数为NA |
| C.0.1molCnH2n+2中含有的碳碳单键数为0.1nNA个 |
| D.标准状况下,11.2L四氯化碳所含分子数为0.5 NA |
下列有关说法不正确的是
| A.氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 |
| B.在金刚石晶体中,1mol碳原子形成2mol碳碳共价键 |
| C.金属铜的晶体堆积模型是六方最密堆积,其配位数是12 |
| D.在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻 |
目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中不正确的是
| A.是一种新型化合物 | B.晶体属于分子晶体 |
| C.分子中不含极性键 | D.相对分子质量为2400 |
“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是
A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元 素氢化物沸点顺序也是AsH3 >PH3 >NH3 素氢化物沸点顺序也是AsH3 >PH3 >NH3 |
| B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
| D.NH3分子的空间构型是三角锥形;则BF3分子的空间构型也是三角锥形 |