中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题: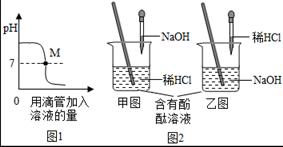
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行的。
②曲线上M点表示 。
③向烧杯中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为 色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 (结果精确到0.1%)。
(2)为证明中和反应是放热反应,某小组进行了如图所
示的实验操作: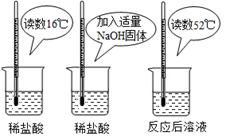
根据上图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出
这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,
再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 |
A |
B |
C |
D |
E |
| 盐酸的溶质质量分数 |
5% |
10% |
15% |
20% |
25% |
| 反应后溶液温度(℃) |
24℃ |
34℃ |
46℃ |
54℃ |
54℃ |
实验结论:影响中和反应放出热量多少的因素 。
交流反思:反应后,烧杯内溶液pH最小的是 (填烧杯编号)。
如图是稀盐酸和氢氧化钠溶液,其中一种物质逐滴加入另一种物质过程中溶液酸碱度的变化情况.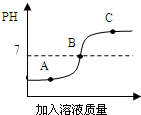
(1)该实验操作是将 滴加到另一种溶液中.
(2)图中 点时溶液中酸和碱恰好完全反应.
(3)若要将36.5克10%的盐酸全部反应完,需要NaOH多少克?(HCl+NaOH═NaCl+H2O)
维生素C(C6H8O6)主要存在于蔬菜,水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:
(1)维生素C的相对分子质量 .
(2)维生素C中碳、氢两种元素的质量比 (写最简比).
(3)维生素C中 元素的质量分数最大.
精盐(NaCl)和纯碱(Na2CO3)是两种常见之物.
(1)用化学方法区别这两种固体,可以选择下列哪一种物质?
| A.白酒 | B.米醋 | C.纯净水 | D.酱油 |
(2)王军同学不慎在精盐中混入了少量纯碱,他想重新得到精盐,设计了以下两个实验方案:
方案一:固体混合物 溶液
溶液 固体
固体
方案二:固体混合物 溶液
溶液 固体
固体
你认为合理的实验方案是 .
说明另一方案不合理的理由: .
(3)假设(2)中固体混合物有53克,加入足量的稀酸充分反应后,生成4.4克,二氧化碳气体,求该固体混合物中氯化钠的质量分数.
火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2 + O2 ="==" 2CaSO4+2CO2.
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的石灰石 克;
(2)处理上述100克废气,可得到含CaSO4 85%的粗产品多少克?(请写出计算过程)
某化工厂利用海水资源进行联合生产,制备氢氧化钠和甲醇等物质。其化工流程如下:
已知:2H2+CO CH3OH
CH3OH
回答下列问题:
(1)电解食盐水的化学方程式为: ;在实验室进行电解水的实验中,为了增强导电性,往往向水中加入少量稀硫酸,而不能加入氯化钠,理由是 。
(2)若该工厂每天可生产80吨甲醇(CH3OH),需要提供 吨氢气。
(3)该工厂每生产80吨甲醇需要消耗多少吨26%的氯化钠溶液?(第3问写出计算过程)