(12分)有机物A(C10H20O2)有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知: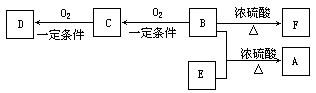
①B分子中没有支链;②D能与碳酸氢钠溶液反应放出二氧化碳;③D、E互为具有相同官能团的同分异构体,E分子烃基上的氢若被Cl取代,其一氯代物只有一种; ④F可以使溴的四氯化碳溶液褪色。
(1)请写出A、D、F的结构简式 A: ;D: ;F: 。
(2)B可以发生的反应有 (填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(3)D、F分子所含的官能团的名称依次是 、 。
(4)写出与D、E具有相同官能团的同分异构体的可能结构简式(任写一种):__________。
A、B、C、D、E是常见的几种粒子,其中A、B为分子,C、E为阳离子,D为阴
离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种粒子反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:;B :;C:;D :(2)写出A、B、E三种微粒反应的离子方程式:
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验
室里从海洋中提取碘的流程如下:
⑴指出提取的过程中有关实验操作名称:①;③;
⑵提取碘的过程中,可供选择的溶剂是__________。
| A.酒精 | B.四氯化碳 | C.乙酸 | D.苯(E)水 |
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏。指出下图所示实验装置中的错误之处;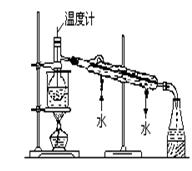
① ; ②;③。
(4)进行上述蒸馏操作时,使用水浴的原因是;最后碘晶在里聚集。
含有下列离子的五种溶液①Ag+ ②Mg2+ ③Al3+ ④ Fe2+ ⑤Fe3+ 试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向④中加入NaOH溶液,现象是有关化学方程式为
、。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1) 在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。原子结构示意图为________________ 。元素⑩名称为单质与水反应化学方程式。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合
物的电子式是:_____________。
(3) ②的最高价氧化物的化学式为写出其最高价氧化物的水化物与足量的铁粉反应的离子方程式_____________________________________________。
(4) 用电子式表示元素④与⑥的化合物的形成过程:,
该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦、①与⑥形成的化合物的电子式、。
(6)③、⑥氢化物的沸点高低;原因
(7)④、⑥、⑦形成的简单离子的半径大小
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%。该化合物的化学式为_________________。
(9)④和③两种元素形成含有非极性键的化合物化学式为______,鉴别该化合物中含④元素常用方法;利用该化合物制取③单质的化学方程式。
已知A、B、C、D、E属于原子序数依次增大的短周期主族元素。短周期元素中C元素的原子半径最大,A的原子半径最小。B元素能形成一种碱性气体。E元素原子的最外层电子数是次外层电子数的一半,且在周期表中与D元素相邻。
(1)写出3种元素的名称:C________ 、D_________、 E___________。
(2)写出D元素在周期表中的位置:__________________________。
(3)画出C元素原子的结构示意图:____________________。
(4)写出D、E的氧化物分别与强碱溶液反应的离子方程式:
___________________________________________;
___________________________________________。
(5)A、B两元素能形成一种5核10电子的阳离子,请叙述实验室检验溶液中的该离子的操作方法:___________________________________________
____________________________________________________。