原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
某温度下,C和H2O(气)在密闭容器中发生下列反应:
C(固)+H2O(气)  CO(气)+H2(气); CO(气)+H2O(气)
CO(气)+H2(气); CO(气)+H2O(气)  CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为()
CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为()
| A.0.1mol/L | B.0.9mol/L | C.1.8mol/L | D.1.9mol/L |
在一定条件下,向2L密闭容器中充入3molX气体和1molY气体,发生下列反应:2X(气)+Y(气)  3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是
3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是
| A.c(Z)=0.45mol/L | B.c(Z)=1.20mol/L |
| C.c(W)=1.00mol/L | D.c(W)=0.80mol/L |
在高温下,用CO还原m g氧化铁得n g铁,已知氧的相对原子质量为16,则铁的相对原子质量为()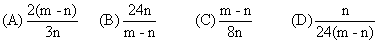
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是()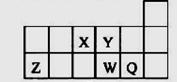
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| C.离子Y2-和Z 3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所研究成功。1mol这种18O2气体中含中子的物质的量为()
| A.10mol | B.16mol | C.20mol | D.36mol |