将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g) ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
| A.保持恒容,平衡后再降低温度,平衡常数减小 |
| B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大 |
| C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8 |
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是: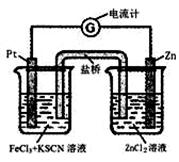
| A.正极反应为Zn-2e-→Zn2+ |
| B.左烧杯中溶液的红色变浅 |
| C.Pt电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
把下列4种X的溶液分别加入4个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓和地进行反应。其中反应速率最大的是
| A.20mL3mol·L-1的X溶液 | B.20mL2mol·L-1的X溶液 |
| C.10mL4mol·L-1的X溶液 | D.10mL2mol·L-1的X溶液 |
对于可逆反应:aA(g)+bB(g) mC(g)+ nD(g);△H<0,下列说法正确的是
mC(g)+ nD(g);△H<0,下列说法正确的是
| A.浓度改变平衡必移动 | B.增大压强平衡必移动 |
| C.升高温度平衡必移动 | D.导入氦气平衡必移动 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5μmol·L-1·min-1和2.0μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0μmol·L-1 |