影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
| ②____________ |
|
反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。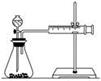
(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
(1)某有机物含有C、H、O三种元素。经燃烧分析实验测定其碳的质量分数是64.86%。下图是该有机物的质谱图。则该有机物的分子式为
(2)完全燃烧某有机物4.3 g生成4.48 L(标准状况)CO2和2.7 g H2O。则该有机物的实验式为
醇在催化作用下氧化成醛的反应是绿色化学的研究内容之一。某科研小组研究了钯催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂)。实验结果如下: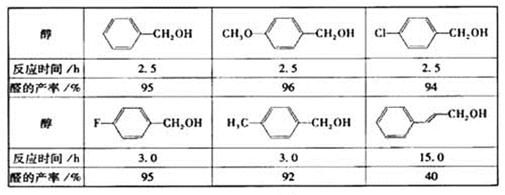
分析表中数据,得到钯催化剂催化效果的主要结论是
(写出2条)。
按题给信息完成方程式(注意:有机物要写结构简式)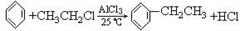
(1)R—Br+2Na+Rˊ—Br —→ Rˊ—R+2NaBr,Rˊ、R为烃基,可相同,也可不相同。
则CH3CH2Br+CH2=CHBr+2Na—→_______ ________。
(2)傅瑞德尔-克拉福茨反应是在苯环上引入烷基的反应,例如:
|
(1)某芳香烃的分子式为C8H10,它的一氯代物有二种,则其结构简式为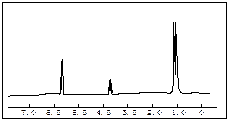
 (2)环己烷(C6H12)有12种结构,其中含三元环(三角形)的有种。
(2)环己烷(C6H12)有12种结构,其中含三元环(三角形)的有种。
(3)在分子中,处于同一平面上的原子最多有
个。
(4)化合物A和B的分子式都是C3H8O,A的核磁共振氢谱图如左图所示,并且峰面积比分别为
1:1:6,
则A的结构简式为。
(由CH3CH2Cl经过3步制乙二醇,写出化学方程式,注明反应条件及反应类型:
(1)反应
(2)反应
(3)反应