元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
会生活密切相关,下列说法正确的是:( )
| A.PM2.5是指空气中直径≤ 2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm =10 -6 m) |
| B.甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C.有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 |
| D.亚硝酸钠是有毒物质,不能添加到食物中 |
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应A(g)+B(g) xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
A.x等于2
B.向平衡后的乙容器中充入氦气可使c(A) 增大
C.将乙容器单独升温,可使乙容器中各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2 molA、2 molB,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1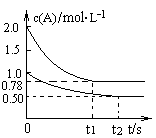
下列实验装置或操作能达到实验目的的是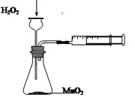


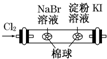
ABC D
| A.定量测定反应速率 | B.验证Na和水反应的热效应 |
| C.酸碱中和滴定 | D.证明氧化性Cl2>Br2>I2 |
下列方程式中正确的是
| A.FeCl2溶液滴加碘水:2Fe2++I2=2Fe3++2I— |
| B.双氧水中滴加2滴FeCl3溶液:2Fe3++H2O2=2Fe2++O2↑+2H+ |
| C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O |
| D.在Mg(OH)2悬浊液中滴加氯化铵溶液:Mg(OH)2+2NH4Cl=2NH3·H2O+MgCl2 |
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):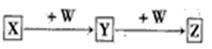 ,下列说法不正确的是
,下列说法不正确的是
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可生成Y |
| C.若X是金属铝,则W可能是NaOH溶液 |
| D.若X是甲醇,则X、的相对分子质量可能相差14 |