(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。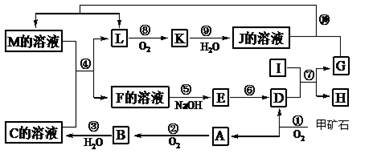
请填写下列空白:
(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为 。反应⑦属于 。
A.吸热反应 B.放热反应 C.置换反应 D.氧化还原反应
(3)反应⑩的离子方程式为 。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。该反应的化学方程式是: 。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为 。
下列家庭小实验不能制得溶液的是()
| A.食盐 | B.饱和FeCl3溶液 | C.蔗糖 | D.碘 |
下列物质中,属于电解质的是()
| A.CO2 | B.石墨 | C.K2SO4 | D.NaOH溶液 |
下列各溶液中,Na+浓度最大的是( )
| A.0.8L0.4mol/L的NaOH溶液 | B.0.2L0.15mol/L的Na3PO4溶液 |
| C.1L0.3mol/L的NaCl溶液 | D.0.4L0.5mol/L的NaCl溶液 |
在同温同压条件下,分子数相同的任意两种气体,它们的( )
| A.体积都是22.4L | B.密度相同 |
| C.所占体积相同 | D.原子数目相同 |
下列物质中所含分子的物质的量最多的是()
| A.56g N2 | B.1.5mol O2 |
| C.标准状态下22.4L Cl2 | D.3.01×1023个硫酸分子 |