H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):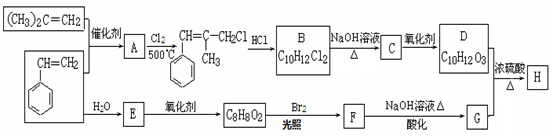
已知:①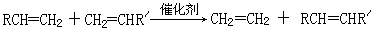
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)A→B反应过程中涉及的反应类型有 、 。
(2)生成A的化学方程式: 。
(3)D分子中含有的官能团名称: 。
(4)E的分子式: 。
(5)H的结构简式: 。
(6)同时满足下列条件的G的同分异构体有 种(不包括立体异构):
①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基。
其中核磁共振氢谱为5组峰的为 (写结构简式)。
将下列性质的序号,填入题后面对应的括号中:
| A.脱水性; | B.强酸性; | C.二元酸; | D.强氧化性 E. 吸水性 |
(1)将胆矾放入装有浓 的干燥器中,过一段时间胆矾变白色
的干燥器中,过一段时间胆矾变白色
(2)NaOH与 反应,可生成
反应,可生成 和
和 这两种盐
这两种盐
(3)在烧杯中放入蔗糖,滴入浓 变黑
变黑
(4)在稀HNO 中放入铝片就产生NO
中放入铝片就产生NO
(5)用稀硫酸清洗金属表面的氧化物
已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O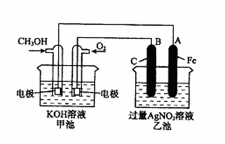
(1)请回答图中甲、乙两池的名称。甲池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式: 通入O2的电极的电极反应式是
A(Fe)电极的电极反应式为
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显(填“酸性”“中性”或“碱性”)。理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是。A.c(A2-)+c(HA-)+c(H2A)="0.1" mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能是0.11 mol·L-1(填“<”、“>”或“=”),理由是。
下表是不同温度下水的离子积的数据:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO )=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,
)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,
则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.